研究内容
低温適応酵素の分子メカニズム解明
好熱菌由来耐熱性酵素は産業用酵素などとして注目を浴び、基礎研究から応用研究が盛んになされています。これに対し低温適応酵素も幅広い分野での産業利用の可能性が謳われているにも関わらず、そこまで至っていません。これは低温菌や低温適応酵素の研究があまり進んでいないことと低温適応酵素の安定性が低いと信じられていることが考えられます。
そこで私たちの研究グループでは低温適応酵素のタンパク質工学的利用を狙い、酵素の低温適応酵素のタンパク質工学的利用を狙い、酵素の低温適応機構を原子レベルで解明することを目指しています。
南極産好冷細菌Pseudoalteromonas sp.AS-131由来グルコキナーゼは低温適応酵素にも関わらず、高い熱安定性をもつことが明らかになっています。この分子メカニズムを静的・動的構造解析(X線結晶構造解析(HAG法)・部位特異的スピンラベル電子スピン共鳴法)により解き明かすことで、他の酵素を高熱安定化または低温適応化するための知見を得たいと考えています。
最終的には、得られた知見をもとに様々な酵素を自在に低温適応化、高熱安定化する技術を確立し、これまでにない新しいタンパク質工学的利用を目指します。
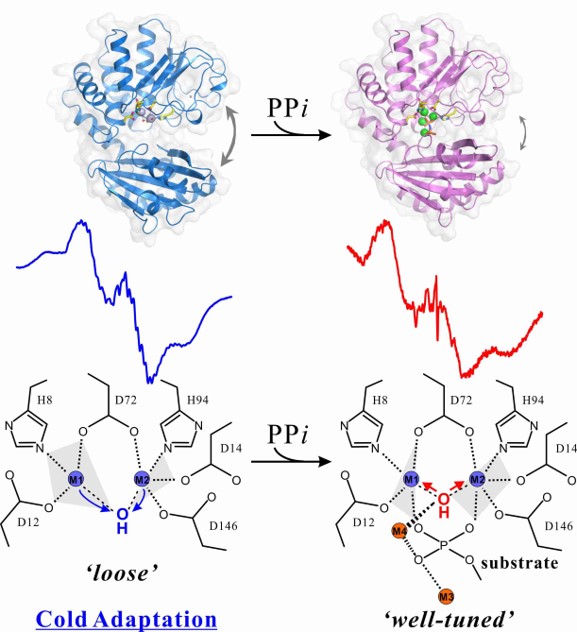
また同じく南極産好冷細菌Shewanella sp. AS-11由来無機ピロフォスファターゼは活性中心に2つのMnイオンを持っています。この酵素は活性中心の金属種を変えるだけで、酵素活性を落とさずに至適温度や熱安定性が変化します。
これは他の酵素には見られない特徴です。私たちはこの特異な性質を分子レベルで解き明かすためX線結晶構造解析に取り組み、基質結合型・非結合型の双方で結晶構造解析に成功しました(PDB ID:6LL7, 6LL8)。
さらに溶液中での構造解析として電子スピン共鳴法を利用し、本酵素だけに見られる活性中心の特異性および基質結合にともなうユニークな活性中心の構造変化を見出しました。
今後は上述したユニークな活性中心の構造変化がなぜもたらされるのかを解明したいと考えています。
(佐賀大学農学部・渡邉 啓一名誉教授、理化学研究所播磨研究所・杉本 宏専任研究員との共同研究)
深海は極地の様な低温環境である上に高圧です。そのような環境からも多くの生物が発見されていますが、そのような生物の持つタンパク質(酵素)はどのようにして過酷な環境に適応しているのでしょうか。これを解き明かすため、マリアナ海溝で採取された耐圧菌由来金属酵素の構造解析や生化学的解析を現在進めています。
本研究を通して、これまでに発見されていないタンパク質機能における法則を見つけ出し、酵素の産業利用の進歩に貢献したいと考えています。
植物由来有用酵素の反応機構解析およびその産業利用
植物は動物とは異なり移動することが出来ません。そのため、植物は厳しい環境の中で少しでも生存を有利にする戦略のため、多種多様なタンパク質・酵素を持つことで様々な物質を生合成し、植物内に貯蔵しています。そのような物質の中には我々ヒトにとって有用な物質や産業利用できる物質が含まれています。
そこで私たちは、どのようにして植物が有用な物質を生合成しているかを構造生物学的見地から解き明かし、さらには産業利用によって新しい科学を創成していきます。
(琉球大学・屋 宏典教授、佐賀大学農学部・渡邊 啓史准教授、理化学研究所播磨研究所・杉本 宏専任研究員との共同研究)
スサビノリにおける色落ちのメカニズム解明
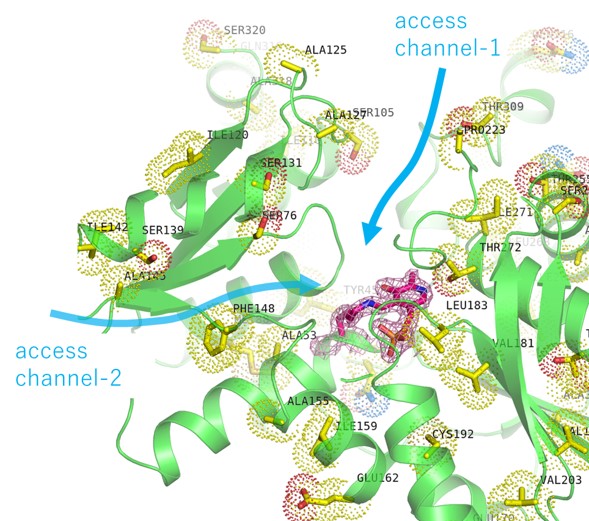
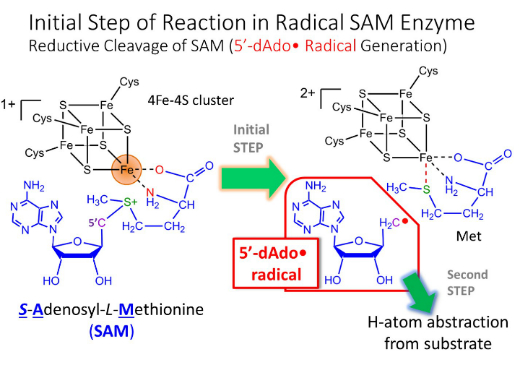
活性中心にユニークな鉄‐硫黄クラスターを持つラジカルSAM酵素スーパーファミリーは、バクテリアからヒトを含む高等生物まで全生物種が保有しており、現在では110,000種類以上同定されている世界最大の酵素スーパーファミリーです。ところが、この酵素群の発見が最近であったことから、その機能や構造が明らかになっているものはわずか100種類ほどしかありません。佐賀県は海苔養殖に有利な有明海を有しており、海苔の生産量は日本一です。ところが、海苔生産において色落ちにより商品価値が落ちることが生産者を悩ましています。
そこで私たちのグループでは佐賀産スサビノリの色落ちに関連する機能未知なラジカルSAM酵素の遺伝子を同定し、単離・精製、機能解明から色落ちしにくい品種開発を目指しています。
(佐賀大学農学部・濱 洋一郎教授との共同研究)
先端電子スピン共鳴法による整数スピン系金属タンパク質研究
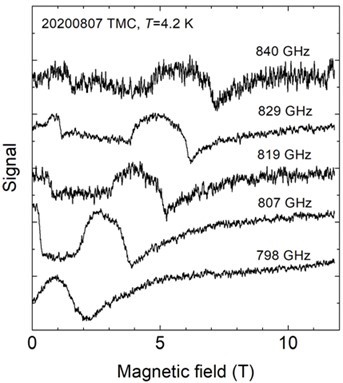
タンパク質には活性中心や構造変化を伴う機能発現に遷移金属イオン(鉄イオン、マンガンイオン等)が重要な働きを持つものが数多く存在しています。それらは金属タンパク質と呼ばれており、その代表例がヘムタンパク質です。ヘムタンパク質は活性中心に鉄ポルフィリンを持っていて、この鉄イオンの電子状態の変化がヘムタンパク質の機能に重要な役割を果たしています。電子状態を詳細に知る有力な手段として電子スピン共鳴法(別名:電子常磁性共鳴法、ESR、EPR)という磁気的測定法があり、これまでESRが金属タンパク質の電子状態研究の中心を担ってきました。
ところが、市販されているESR装置では検出限界があり、すべてのヘムタンパク質、特に整数スピンを持つヘムタンパク質の電子状態研究はあまり進んでいません。
そこで、私たちは市販されているものより強磁場、高周波数ESR装置(神戸大学分子フォトサイエンス研究センターにて開発)や福井大学で開発されているジャイロトロン発振器を利用したジャイロトロンESR装置を用いて、金属タンパク質研究を展開しています。
(神戸大学分子フォトサイエンス研究センター・太田 仁教授、奈良女子大学理学部化学科・藤井 浩教授との共同研究)
酵素反応中間体捕捉法の開発
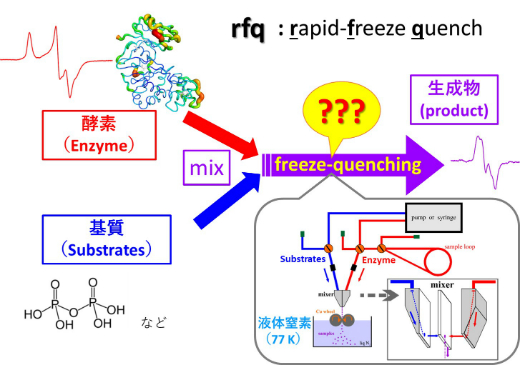
自然界で酵素は人工的には難しい化学反応を”低コスト”で触媒しています。このカラクリを解き明かすことは、生命現象の解明につながるだけでなく、それを利用することで産業・創薬などの様々な分野へ貢献することが出来ます。私たちのグループではタンパク質が基質と結合し、化学反応が最終的な生成物になるまでを”観る”ための技術として、図のような高速混合凍結装置(rapid mixing freeze quench:rfq)を開発しています。
この装置によりタンパク質がどのように構造を変えて上手く化学反応を触媒しているかを”コマ送りを見る”かのように、原子レベルで解き明かすことが出来ます。
現在の装置では200 µs以上の反応中間体の捕捉が可能です。今後さらにミキシング部の開発・改良を計画しています。
またさらにこの装置を用いて、タンパク質ダイナミクス研究も行っています。
この装置の一号機は大阪大学基礎工学部H研の堀 洋先生と大阪大学蛋白質科学研究所(当時)の高橋 聡先生(現、東北大学多元物質科学研究所教授)が作製されたものです。
他大学・研究機関との共同研究
北海道大学・先端生命科学研究院・X線構造生物学研究室(姚 閔教授)
東北大学・生命科学研究科・応用生命分子解析分野(田中 良和教授)
産業技術総合研究所・創薬基盤研究部門・最先端バイオ技術探求グループ(鴫 直樹主任研究員)
分子科学研究所生命・錯体分子科学研究領域・青野研究室(青野 重利教授)
理化学研究所・播磨研究所・生命系放射光利用システム開発チーム(杉本 宏専任研究員)
兵庫県立大学・大学院生命理学研究科・細胞制御学II分野(當舎 武彦教授)
大阪大学・産業科学研究所・量子ビーム物質科学研究分野(小林 一雄特任教授)
(順不同)
研究費
現在進行中のプロジェクト
文部科学省・科学研究費補助事業
基盤研究(B)
『EPR・X線による深海および南極海微生物由来酵素の高活性・高安定性機構の解明』
研究代表者
研究期間:2023-2025
新学術領域研究(研究領域提案型)
『生命金属動態の解明に向けた光照射EPR技術による新しい酵素反応機構解析法の開発』
研究代表者
研究期間:2022-2023
挑戦的研究(萌芽)
『新しい金属酵素研究へのテラヘルツ電子スピン共鳴法の応用』
研究代表者
研究期間:2021-2023
基盤研究(B)
『核共鳴散乱分光を駆使した鉄複核中心と気体分子の化学の解明』
研究分担者(代表者:當舎武彦先生)
研究期間:2021-2023
基盤研究(B)
『tRNA硫黄修飾塩基の生合成・分解系の多様性とその分子基盤』
研究分担者(代表者:鴫直樹先生)
研究期間:2021-2023
基盤研究(C)
『熱帯樹木由来高活性イソプレン合成酵素の探索とハイブリッド型発酵用高機能酵素の開発』
研究分担者(代表者:屋宏典先生)
研究期間:2022-2024
その他
神戸大学分子フォトサイエンス研究センター共同利用
『テラヘルツESR法による金属タンパク質の電子状態研究』
研究代表者:堀谷 正樹
研究期間:2023-2024
福井大学遠赤外領域開発研究センター共同研究
『ジャイロトロンESR法による整数スピン系金属タンパク質の信号検出』
研究代表者:堀谷 正樹
研究分担者:黒岩 もね
研究期間:2023-2024
終了したプロジェクト
文部科学省・基盤研究(B)
『好冷細菌由来低温適応酵素グルコキナーゼにおける低温適応機構の分子メカニズム解明』
研究代表者
研究期間:2018-2020
福井大学遠赤外領域開発研究センター共同研究
『ジャイロトロンESR法による整数スピン系金属タンパク質の信号検出』
研究代表者
研究分担者:宮崎 ひかる
文部科学省・卓越研究員事業
Leading Initiative for Excellent Young Researchers (LEADER)
研究代表者(卓越研究員)
研究期間:2016-2021
神戸大学分子フォトサイエンス研究センター共同利用
『テラヘルツESR法による金属タンパク質の電子状態研究』
研究代表者
分担研究者:二宮 春菜
研究期間:2017-2021
文部科学省・科学研究費補助事業
研究活動スタート支援
『低温適応酵素における低温適応機構の分子メカニズムの解明』
研究代表者
研究期間:2017-2018
